
관상동맥 중재시술은 지난 20년간 비약적인 발전을 하였고, 2세대 약물방출 스텐트 (Drug-eluting stent, DES)의 개발 이후 스텐트 재협착을 포함한 임상사건의 발생률이 현저하게 감소하였다.1 하지만, 2세대 약물방출 스텐트를 사용하더라도 후기 스텐트 혈전증을 포함한 부작용 사건의 위험에 여전히 노출되어 있으며, 진성분지병변 (true bifurcation lesion), 만성폐색병변 (chronic total occlusion), 좌주간지병변 (unprotected left main disease), 스텐트 재협착병변 (in-stent restenosis), 긴 스텐트 삽입 (long coronary artery lesions with an expected stent length of at least 38 mm), 다혈관 치료 (multivessel PCI involving at least 2 major epicardial coronary arteries that are treated at the same time), 3개 이상 스텐트 삽입이 필요한 병변 (at least 3 planned stents), 심한 석회화 병변 (severely calcified lesions), 관상동맥 개구부 병변 (ostial lesions of a major epicardial coronary artery) 등의 복잡한 관상동맥 병변의 경우 단순 병변에 비해 관상동맥 중재시술 후의 예후가 유의하게 좋지 않음이 알려져 있다.2,3
관상동맥 중재시술에 있어 가장 기본이 되는 영상검사는 혈관조영술이지만 이의 제한점은 이미 잘 알려져 있다.4 혈관조영술 검사만으로는 죽상경화반의 모양, 성질, 및 양을 파악하기 어려우며 스텐트 삽입 후에도 스텐트 malapposition이나 underexpansion 여부 및 관상동맥 박리 (dissection) 등 최적의 스텐트 삽입 여부를 판단하기 어렵다는 단점이 있다. 이를 보완하기 위해 혈관내 초음파 (Intravascular ultrasound, IVUS)와 광간섭단층촬영 (Optical coherency tomography, OCT)가 개발되었고, 이러한 관상동맥내 영상장비는 죽상경화반의 분포와 성질에 대한 정보 뿐만 아니라,
최적의 스텐트 사이즈와 landing zone을 결정하는데 도움을 주고, 스텐트 삽입 후 발생할 수 있는 malapposition, underexpansion, dissection 등의 급성 합병증을 발견하고 최적화 할 수 있는 정보를 제공한다.5,6 관상동맥내 영상장비의 임상적 유용성에 대해 몇 건의 무작위 배정 임상시험 (randomized controlled trial)이 보고되었고, 이들 연구에서 관상동맥내 영상장비를 사용한 관상동맥 중재시술의 예후가 혈관조영술만에 기반한 중재시술 후의 예후보다 개선되었음이 보고된 바 있다.7-11 그러나 이들 연구들은 평가 환자의 수 및 추적관찰기간이 제한적이거나, 특정 관상동맥 병변만을 대상으로 이루어진 연구였고, 따라서 임상근거가 충분하지 않아 현재의 ACC/AHA 및 ESC/EACTS 가이드라인은 관상동맥 중재시술시 관상동맥내 영상장비의 사용을 Class IIA의 수준으로 권고하고 있다.12,13
이에 RENOVATE-COMPLEX-PCI 연구팀은 2017년 7월부터 관상동맥 복잡병변에 대한 중재시술시, 관상동맥내 영상장비를 사용한 관상동맥 중재시술과 혈관조영술만에 기반한 중재시술의 장기 예후를 비교하기 위한 무작위 배정 임상시험을 기획하였고, 2018년 5월부터 2021년 5월까지 국내 20개 기관의 총 1639명의 복잡병변 환자를 관상동맥내 영상장비를 사용한 관상동맥 중재시술군 (1092명)과 혈관조영술만에 기반한 중재시술군 (547명)으로 무작위 배정하여 연구를 진행했다. 관상동맥내 영상장비를 사용한 관상동맥 중재시술군에서 혈관내 초음파와 광간섭단층촬영의 선택은 병변의 특성과 임상적 판단에 따라 시술의의 결정에 따랐다. 복잡병변은 진성분지병변, 만성폐색병변, 좌주간지병변, 스텐트 재협착병변, 긴 스텐트 삽입이 필요한 병변, 다혈관 중재시술, 3개 이상 스텐트 삽입이 필요한 병변, 심한 석회화 병변, 관상동맥 개구부 병변으로 정의되었다(그림 1)
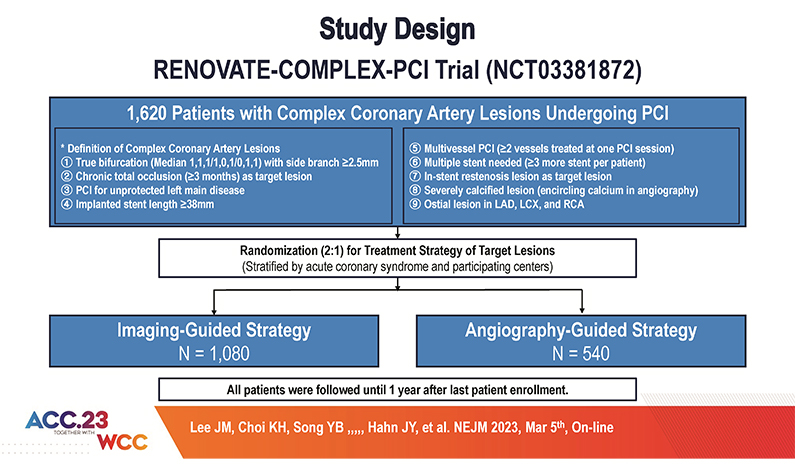
[그림 1] RENOVATE-COMPLEX-PCI Trial 연구 디자인
등록 대상자의 평균 나이는 65.6세이고 79.3%가 남성이었다. 49.2%의 환자는 안정형 협심증, 50.8%의 환자는 급성관상동맥증후군을 가지고 있었다. 관상동맥 복잡 병변의 구성은 진성분지병변 21.9%, 만성폐색병변 19.5%, 좌주간지병변 11.7%, 스텐트 재협착병변 14.4%, 긴 스텐트 삽입이 필요한 병변 54.8%, 다혈관 중재시술 37.9%, 3개 이상 스텐트 삽입이 필요한 병변 18.6%, 심한 석회화 병변 14.1%, 관상동맥 개구부 병변 15.3%였다. 전체 병변의 97.3%가 약물방출스텐트, 2.7%는 약물코팅풍선으로 중재시술을 시행하였고, 98.4%의 시술이 성공적으로 마무리되었다. 관상동맥내 영상장비를 사용한 관상동맥 중재시술군에 배정된 환자 중 98.7%가 관상동맥내 영상장비를 사용하였고, 74.2%는 혈관내 초음파, 25.8%는 광간섭단층촬영을 사용하였다.
약 2.1년의 추적관찰기간 동안 (Interquartile range 1.4 - 3.0년), 본 연구의 1차 종결점이었던, 표정혈관실패 (Target vessel failure, a composite of cardiac death, target vessel-related myocardial infarction, or clinically driven target vessel revascularization)의 발생률은 관상동맥내 영상장비를 사용한 관상동맥 중재시술군에서 7.7%, 혈관조영술만에 기반한 중재시술군에서 12.3%로, 관상동맥내 영상장비를 사용한 관상동맥 중재시술군의 위험도가 36% 유의하게 낮은 결과를 보였다 (hazard ratio, 0.64; 95% confidence interval, 0.45 to 0.89; P=0.008) (그림 2).
1차 종결점 뿐만 아니라, procedure-related myocardial infarction를 제외한 cardiac death, spontaneous target vessel-related myocardial infarction, or clinically driven target vessel revascularization의 위험도 관상동맥내 영상장비를 사용한 관상동맥 중재시술군에서 혈관조영술만에 기반한 중재시술군보다 41% 낮았으며 (5.1% vs. 8.7%; hazard ratio, 0.59; 95% confidence interval, 0.39 to 0.90), cardiac death의 위험도 역시 53% 낮은 결과를 보였다 (1.7% vs. 3.8%; hazard ratio, 0.47; 95% confidence interval, 0.24 to 0.93). 뿐만 아니라, 관상동맥내 영상장비를 사용한 관상동맥 중재시술군은 혈관조영술만에 기반한 중재시술군보다 target vessel-related myocardial infarction (3.7% vs. 5.6%; hazard ratio, 0.74; 95% confidence interval, 0.48 to 1.25), definite stent thrombosis (0.1% vs. 0.7%; hazard ratio, 0.25; 95% confidence interval, 0.02 to 2.75)의 발생률 역시 낮은 경향을 보였다. 양 군에서 재시술률 (repeat revascularization)과 시술과 관련한 합병증의 빈도에는 차이가 없었다. 또한 관상동맥내 영상장비를 사용한 중재시술군에서, 연구시작전 정의한 시술 최적화 (procedural optimization)를 달성한 군에서 그렇지 못한 군이나, 혈관조영술만에 기반한 중재시술군보다 1차종결점의 발생률이 더욱 낮은 결과를 보였다 (시술 최적화 달성군 6.0%, 시술 최적화를 달성하지 못한 군 8.9%, 혈관조영술만에 기반한 중재시술군 12.3%).
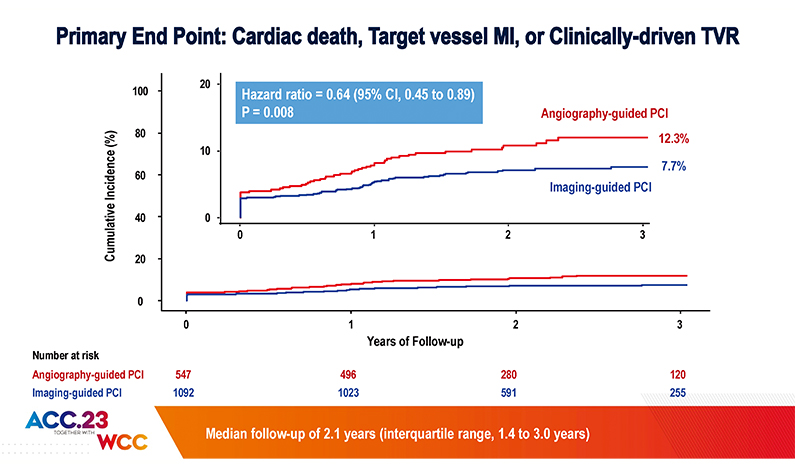
[그림 2] 두 군의 1차 종결점 (Primary End Point) 발생 비교

RENOVATE-COMPLEX-PCI trial은 앞서 보고되었던 무작위 배정 임상시험과 확연하게 구분되는 특징을 가지고 있는데, 첫째, RENOVATE-COMPLEX-PCI trial은 특정 복잡병변이 아닌, 실제 임상에서 마주치는 다양한 형태의 복잡병변을 모두 대상으로 한 연구로써 실제 임상현장에 적용할 수 있는 높은 generalizability를 가지고 있다. 둘째, 앞선 무작위 배정 임상시험들이 관상동맥내 영상장비를 사용한 시술 최적화에 다양한 기준을 가지고 수행된 반면, RENOVATE-COMPLEX-PCI trial은 현재 가장 최신의 시술 최적화 (procedural optimization)에 대한 전문가 합의문에 따른 표준화된 시술 최적화 프로토콜을 적용하여 진행되었다.5 셋쩨, 기존의 무작위 배정 임상시험들에서 관상동맥내 영상장비를 사용한 중재시술의 이점이 주로 재시술률을 줄임으로써 나타난 반면, RENOVATE-COMPLEX-PCI trial에서는 관상동맥내 영상장비를 사용한 중재시술의 이점이 주로 cardiac death 또는 target vessel-related myocardial infarction과 같은 hard clinical end point를 감소시킴으로써 나타났다. 실제로, cardiac death 또는 target vessel-related myocardial infarction의 위험도가 관상동맥내 영상장비를 사용한 중재시술군에서 혈관조영술만에 기반한 중재시술군보다 37% 낮은 위험도를 보였다. 이러한 차이점은 RENOVATE-COMPLEX-PCI trial이 기존의 선행연구들보다 더 많은 환자를 등재하고 추적관찰 기간 역시 더 길며, 관상동맥 복잡병변을 가진 환자만을 대상으로 하였기 때문으로 생각된다.
결론적으로, RENOVATE-COMPLEX-PCI trial은 관상동맥 복잡병변에 대한 고위험 중재시술시, 관상동맥내 영상장비를 사용하고, 표준화된 시술 최적화 프로토콜을 적용함으로써, 혈관조영술만에 기반한 중재시술보다 중재시술 후 환자의 예후를 유의하게 개선함을 증명한 최초의 대규모 무작위 배정 임상시험이며, 본 연구결과는 단순히 관상동맥내 영상장비를 사용하는 것 보다, 꼼꼼한 시술의 최적화가 더욱 중요함을 시사하고 있다. 본 연구는 관상동맥 복잡병변에 대한 고위험 중재시술시, 관상동맥내 영상장비를 사용한 시술 최적화는 더 이상 Class IIA로 권고되는 선택사항이 아니라, 환자의 hard clinical end point를 감소시키고 환자의 예후를 개선시키기 위한 필수적인 사항이 되어야함을 강력하게 시사하며, 실제 임상 진료에 직접적인 영향을 미칠 것으로 기대된다.
이 연구의 결과는 2023년 미국 심장학회 (ACC/WCC 2023)의 Late-Breaking Clinical Trials 세션에서 발표 후 New England Journal of Medicine 3월호 (N Engl J Med. 2023 Mar 5; DOI: 10.1056/NEJMoa2216607)에 동시 게재되었다.
1. Bangalore S, Kumar S, Fusaro M, et al. Short- and long-term outcomes with drug-eluting and bare-metal coronary stents: a mixed-treatment comparison analysis of 117 762 patient-years of follow-up from randomized trials. Circulation 2012;125:2873-91.
2. Baber U, Kini AS, Sharma SK. Stenting of complex lesions: an overview. Nat Rev Cardiol 2010;7:485-96.
3. Giustino G, Chieffo A, Palmerini T, et al. Efficacy and Safety of Dual Antiplatelet Therapy After Complex PCI. J Am Coll Cardiol 2016;68:1851-64.
4. Mintz GS, Popma JJ, Pichard AD, et al. Limitations of angiography in the assessment of plaque distribution in coronary artery disease: a systematic study of target lesion eccentricity in 1446 lesions. Circulation 1996;93:924-31.
5. Raber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J 2018;39:3281-300.
6. Johnson TW, Raber L, di Mario C, et al. Clinical use of intracoronary imaging. Part 2: acute coronary syndromes, ambiguous coronary angiography findings, and guiding interventional decision-making: an expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J 2019;40:2566-84.
7. Hong SJ, Kim BK, Shin DH, et al. Effect of Intravascular Ultrasound-Guided vs Angiography-Guided Everolimus-Eluting Stent Implantation: The IVUS-XPL Randomized Clinical Trial. JAMA 2015;314:2155-63.
8. Chieffo A, Latib A, Caussin C, et al. A prospective, randomized trial of intravascular-ultrasound guided compared to angiography guided stent implantation in complex coronary lesions: the AVIO trial. Am Heart J 2013;165:65-72.
9. Jakabcin J, Spacek R, Bystron M, et al. Long-term health outcome and mortality evaluation after invasive coronary treatment using drug eluting stents with or without the IVUS guidance. Randomized control trial. HOME DES IVUS. Catheter Cardiovasc Interv 2010;75:578-83.
10. Gao XF, Ge Z, Kong XQ, et al. 3-Year Outcomes of the ULTIMATE Trial Comparing Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation. JACC Cardiovasc Interv 2021;14:247-57.
11. Kim BK, Shin DH, Hong MK, et al. Clinical Impact of Intravascular Ultrasound-Guided Chronic Total Occlusion Intervention With Zotarolimus-Eluting Versus Biolimus-Eluting Stent Implantation: Randomized Study. Circ Cardiovasc Interv 2015;8:e002592.
12. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2022;145:e18-e114.
13. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019;40:87-165.