현재
포사맥스, 10년 간 대규모 추적연구 결과 장기 투여 시 고관절 골절 위험 감소 입증1

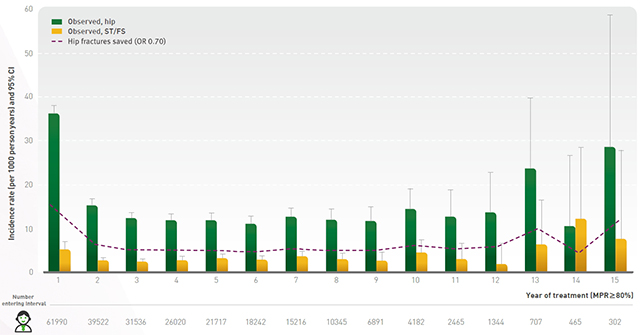
(포사맥스 복약순응도(Medication Possession Ratio, MPR) 80% 이상 환자 대상
1,000인년 당 고관절 골절 및 전자하 및 간부 대퇴골절 발생률 (95% CI) 분석결과1)
한국MSD의 골다공증 치료제 포사맥스(성분명 알렌드로네이트)가 1996년부터 2007년까지 포사맥스를 처음 복용하기 시작한 환자(median follow-up time 6.9년)에서 고관절 골절 발생 위험을 감소시키고, 전자하 및 간부 대퇴골절 위험도는 증가하지 않는 것으로 나타났다.1 영국 옥스포드 의대 정형외과 센터의 다니엘 프리에토 알함브라(Daniel Prieto-Alhambra) 박사 연구팀이 10년 이상(1996년~2007년) 진행한 리얼월드(Real World) 대규모 코호트 연구 결과다.1
연구팀은 포사맥스 복용 이력이 없는 50-94세 남녀 61,990명을 대상으로 두 가지 환자 대조군 연구(전자하 및 대퇴골절, 고관절골절)를 진행하였다.1 복약순응도가 높은 환자(MPR>80%)에게서 포사맥스의 5년 이상 복용은 고관절 골절 위험을 유의하게 감소시켰으며(5-10년, p<0.001; 10년 이상, p=0.03), 10년 이상 장기간 복용 시 약 30%까지 고관절 골절 위험이 감소하는 것으로 나타났다.1
또한 포사맥스의 10년 이상 장기간 복용은 전자하 및 대퇴골절 위험도를 증가시키지 않았다.1 첫 10년 동안 고관절 골절 발생률은 1,000인년(person years) 당 첫 해의 36.2명에서 10~15명으로 감소되었으며, 전자하 및 대퇴골절 발생 수는 1,000인년 당 2.7~4.6명으로 유지되었다.1 이는 모든 전자하 및 대퇴골절이 비정형 골절이라 할지라도, 고관절에 대한 이점을 상쇄시키기에는 낮은 수치다.1
포사맥스 70mg은 1995년에 미국 식품의약국(FDA, Food and Drug Administration)으로부터 허가를 받았으며, 폐경기 여성에 이어 남성 골다공증 환자에 대해서도 시판허가를 받았다.2, 3 비스포스포네이트 약물은 강력한 골흡수 억제제로 골절 예방 효과와 비용 대비 높은 효과 등의 장점으로 전 세계적으로 가장 많이 처방되어 왔다.1, 3 하지만 비정형 대퇴골절 발생 부작용에 대한 우려가 제기되면서 환자들이 약제의 장기간 처방 혜택을 누리지 못하는 경우가 많았다.1
한국MSD 의학부 김진주 이사는 “이번 연구는 10년 이상의 대규모 추적 연구로, 포사맥스가 장기간 지속적으로 약물을 사용한 환자군에서 고관절 골절의 위험을 낮추고, 전자하 및 간부 대퇴골절의 위험은 높이지 않음을 확인했다”며 “이번 연구 결과가 포사맥스의 장기간 사용에 대한 위험 대비 높은 효용성 측면을 지지해줄 수 있을 것으로 기대한다.”고 말했다.
한편 이번 연구 결과는 권위 있는 국제학술지 영국의학저널(BMJ, British Medical Journal) 6월호에 등재됐다.1
[ 포사맥스 70mg 주요 안전성 정보 ]
[효능•효과] 1. 폐경 후 여성의 골다공증 치료 2. 남성의 골다공증 치료
[용법•용량] 1주 1회 1정을 아침에 음식물, 음료수 또는 다른 약물 섭취 최소한 30분 전에 충분한 양의 물과 함께 복용한다. 광천수, 보리차를 포함한 다른 음료나 음식, 약물은 알렌드로네이트의 흡수를 저하시킬 수 있다. 아침에 일어나자마자 복용하여야 하며 약물을 위로 신속히 도달시켜 식도자극 가능성을 감소시키기 위해 충분한 양의 물(170 ∼ 230 ml)로 삼켜야 한다. 복용 후에는 적어도 30분간 그리고 최초 음식물 섭취 후까지 누워서는 안 된다.
[사용상의 주의사항] ◎ 포사맥스를 투여받은 환자에서 때때로 출혈과 함께 식도염, 식도궤양, 식도미란과 같은 식도 이상반응이 보고된 바 있으며, 드물게 식도폐색 또는 천공으로 발전하였다. ◎ 포사맥스는 다음 환자에는 투여하지 말아야 한다. 1) 식도협착 또는 무이완증과 같이 식도 배출을 지연시키는 식도이상 환자, 2) 적어도 30분 동안 똑바로 앉거나 서 있을 수 없는 환자, 3) 포사맥스의 성분에 과민증인 환자, 4) 저칼슘혈증 환자, 5) 유당을 함유하고 있으므로, 관련 유전적인 문제가 있는 환자.
[이상반응] ◎ 폐경 후 여성을 대상으로 실시한 골다공증 치료 임상시험에서 연구자가 포사맥스® 10mg과 관련이 있을 가능성이 있거나, 상당히 관련이 있거나, 또는 명확한 관련이 있는 것으로 판단하고 위약군보다 높은 비율로 1% 이상의 환자에서 보고된 상부 위장 관계 이상반응은 다음과 같다. 복통(6.6% vs 위약 4.8%), 소화불량(3.6% vs 위약 3.5%), 식도궤양(1.5% vs 위약 0.0%), 연하 곤란(1.0% vs 위약 0.0%), 복부 팽만(1.0% vs 위약 0.8%). 추가로 폐경 후 여성을 대상으로 실시한 골다공증 치료 임상 시험에서 연구자가 포사맥스 10mg과 관련이 있을 가능성이 있거나, 상당히 관련이 있거나, 또는 명확한 관련이 있는 것으로 판단하고 위약군보다 높은 비율로 1% 이상의 환자에서 보고된 이상반응은 다음과 같다. 변비 (3.1% vs 위약 1.8%), 설사(3.1% vs 위약 1.8%), 방귀(2.6% vs 위약 0.5%), 근골격(골, 근육, 또는 관절), 통증(4.1% vs 위약 2.5%), 두통(2.6% vs 위약 1.5%). ◎ 경구용 비스포스포네이트제제 투여 시 국소적 턱뼈괴사가 드물게 보고되었다. 이 증상은 일반적으로 발치 및/또는 치료가 지연된 국소 감염(골수염 포함)과 연관성이 있었다. ◎ 시판 후 조사에서, 중증이면서 때때로 활동을 할 수 없을 정도의 골, 관절 및/또는 근육의 통증이 골다공증의 예방 및 치료를 위해 승인된 비스포스포네이트계 약물을 복용하는 환자에서 드물게 보고되었다.◎ 장기간(일반적으로 3년 이상) 비스포스포네이트를 투여한 환자 중 일부에서 전자하 및 근위 대퇴골체의 저강도 골절이 보고되었다.◎ 임부, 수유부, 소아, 고령자 및 신장애 환자에 대한 투여 1) 임부에 대한 투여 임부에 대한 시험은 행해지지 않았으므로 이 약을 임부에 투여 시에는 모체나 태아에 대한 잠재적 유익성이 위험성을 상회한다고 판단되는 경우에만 투여한다. 2) 수유부에 대한 투여 콜레칼시페롤과 이 활성대사체는 모유로 이행된다. 알렌드로네이트가 모유 중으로 이행되는지는 알려지지 않았다. 많은 약물들이 모유 중으로 이행되므로 이 약을 수유부에 투여할 경우에는 주의해야 한다. 3) 소아에 대한 투여 이 약은 어린이에게 적용되지 않는다. 4) 고령자에 대한 투여 고령자에게 용량 조절은 필요치 않다. 5) 신장애 환자에 대한 투여 경증 내지 중등도의 신부전 환자(크레아티닌 청소율이 35∼60 mL/min)에 대해서는 용량조절이 필요하지 않으나, 중증의 신부전 환자(크레아티닌 청소율이 35 mL/min미만)에 대해서는 충분한 임상경험이 없으므로 이 약 투여가 권장되지 않는다.

- Abrahamsen B. Eiken P. Prieto-Alhambra D. et al. Risk of hip, subtrochanteric, and femoral shaft fractures among mid and long term users of alendronate: nationwide cohort and nested case-control study. BMJ. 2016;353:i3365.
- FDA, FOSAMAX approval history. Availableat <http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm?fuseaction=> Accessed 09 Sep, 2016.
- Korean Society for Bone and Mineral Research, Physician’s guide for diagnosis & treatment of osteoporosis, 2015.