 메뉴열기
메뉴열기
코로나바이러스 감염증-19(COVID-19)는 2019년 12월 중국 우한에서 처음 발생한 후 중국 전역 및 전 세계로 확산된, 새로운 유형의 코로나바이러스(SARS-CoV-2)에 의한 호흡기 감염질환을 말한다. 인류는 과거에 SARS, MERS 및 H1N1 influenza등의 바이러스질환을 겪으면서 많은 경험과 지식을 축적하면서, 새로운 바이러스질환 발생에 대비해 왔다. 하지만, COVID-19 감염증은 높은 변이 발생 및 전파력을 통해 전세계적으로 전파가 되었고(2020년 6월 현재: 700여 만명의 확진자 및 40여 만명의 사망자), 상대적으로 높은 치사율과 더딘 치료제 및 백신 개발로 인해 인류에 큰 위협이 된 상태다. 이에 현재 적합한 항바이러스제 개발을 위해 전세계적인 개발 및 연구 협업이 활발하게 진행되고 있다.
COVID-19바이러스는 폐포세포에 있는 ACE2 (angiotensin-converting enzyme 2) 수용체를 통해 인체에 전파되고 광범위한 염증 반응을 유발하여 호흡기질환으로 진행한다. 하지만, 호흡기질환 외에도 다양한 장기에 합병증을 유발하여 치명적인 상태로 진행한다. 특히, 폐렴에 동반된 급성 및 만성 심혈관계 질환은 다양한 기전에 의해 발생하고(그림 1), 또 생각보다 흔하다.1 이와 함께 COVID-19 감염증 환자에서 혈전 질환 발생이 상당히 증가되는 것이 확인되고 있어 이의 관리가 향후 임상적으로 중요한 이슈가 되리라 생각된다.

그림 1. COVID-19와 관련된 심혈관계 합병증의 발생 기전1
현재 COVID-19 감염증에 의해 합병증에 의해 사망에 이르는 가장 중요한 기전은 염증-혈전 성향(Thrombo-inflammatory syndrome)의 급격한 증가로 설명되고 있다. COVID-19감염증은 전신 염증반응(systemic inflammation)을 증가시켜 일명 ‘cytokine storm’을 유발할 뿐만 아니라 혈전 성향(pro-coagulant effect)도 같이 증가시킨다(그림 2).2 코로나 바이러스는 monocyte 및 endothelial cell 활성화를 유발시켜 결국 extrinsic coagulation pathway를 활성화시키고, 또한 endothelial cell에 혈소판 및 백혈구 부착을 증가시켜 intrinsic coagulation pathway도 결국 활성화시켜 전체적인 혈전 성향을 증가시킨다. 이전 SARS, MERS 및 H1N1 influenza 감염증 당시에도 일부 혈전 성향이 증가되는 것이 관찰되기는 하였으나, COVID-19 감염증에서 유독 혈전 질환이 많이 관찰되는 원인이 무엇인지는 아직 알려져 있지 않다. 다른 바이러스 감염증에 비해 COVID-19 자체가 염증반응을 더욱 유발하는 성향을 가지거나 viral burden이 월등히 높다는 가설 등이 제시되고 있다.
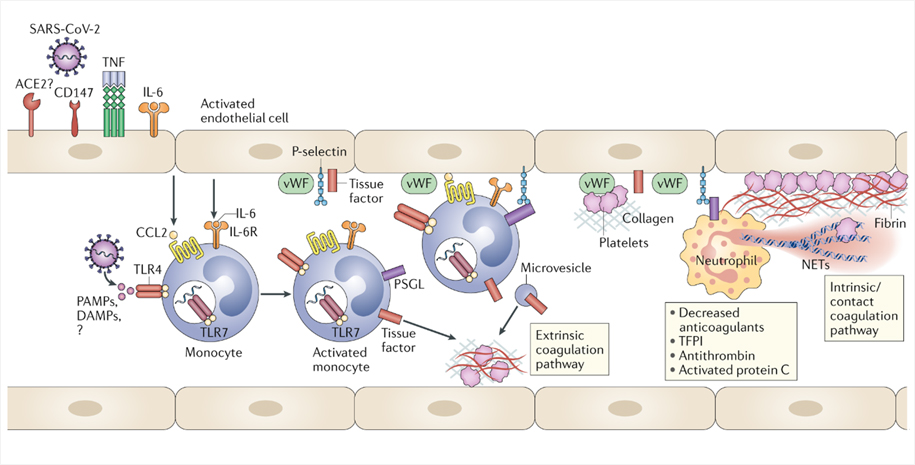
그림 2. COVID-19 감염증에 의한 혈전 성향의 증가 기전2
CCL = CC-chemokine ligand; DAMPs = damage-associated molecular patterns; NETs = neutrophil extracellular traps; PAMPs = pathogen-associated molecular patterns; TFPI = tissue factor pathway inhibitor; TLR = Toll-like receptor; TNF = tumour necrosis factor; vWF = von Willebrand factor
COVID-19 coagulopathy의 임상적 중요성에 대한 힌트는 이미 초기COVID-19 감염증 환자의 부검 소견을 통해 알 수 있다. 즉, 폐 전반에 걸쳐 염증 반응에 의한 광범위한 폐섬유화와 함께 폐포 출혈 및 상당한 fibrin 미세혈전(micro-thrombi)이 관찰된 것이다(PIC, pulmonary intravascular coagulopathy).3 이후 중국, 네덜란드 및 프랑스 등의 COVID-19환자에서 흉부 CT 및 하지 도플러 검사 등을 통해 16-65%에 이를 정도로 흔하게 심부정맥 혈전증(deep-vein thrombosis) 및 폐동맥 혈전증(pulmonary thrombosis)이 관찰되었다.4 또한, 50세 미만의 환자에서 큰 혈관의 뇌졸중 증례가 잇달아 보고되고 있다.5 이런 증례는 특히 중환자실에 입원하는 중증 환자에서 흔하게 관찰되고, 많은 경우에 heparin prophylaxis 시행 중에도 관찰된다. 현재까지 알려진 일반적인 혈액학적 소견은 심한 염증반응 소견(fibrinogen, factor VIII 및 von Willebrand factor 증가)과 함께 D-dimer 수치가 매우 증가되어 있다는 것이다.6 또한, D-dimer 수치가 사망률의 증가와 밀접한 관련이 있다는 분석이 중국 등을 포함한 여러 센터에서 보고되고 있다.
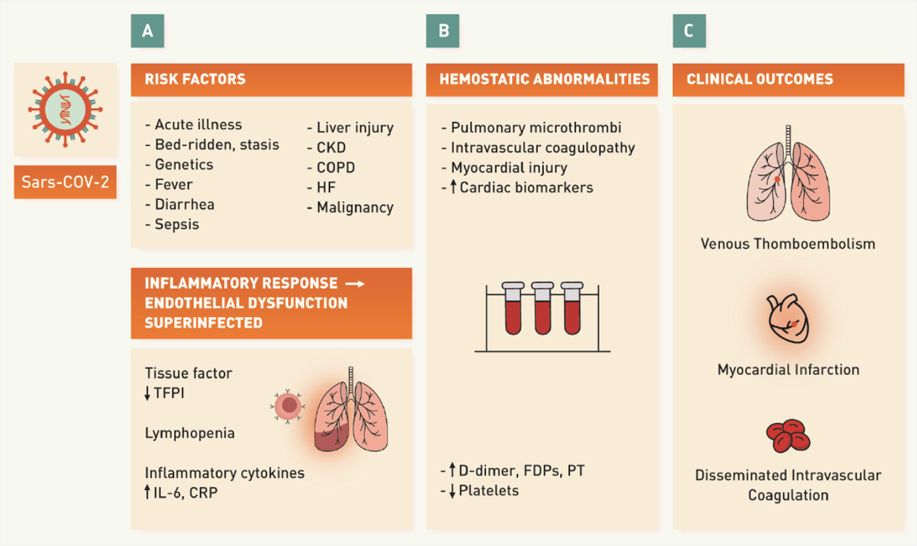
그림 3. COVID-19 감염증의 전반적인 이해6
후향성 분석이라는 한계에도 불구하고 최근에 뉴욕 내 병원들의 경험은 COVID-19 감염증에서 anticoagulation의 유용성을 다시 한 번 지지하였다(총 2773명의 환자 중 28%에서 anticoagulation이 진행됨).7 50% 생존률이 anticoagulation비시행군에서 14일, 시행군에서 20일째 관찰되었고, 기계적 환기장치를 한 경우에는 비시행군에서 9일, 시행군에서 21일째 관찰되었다. 위중한 bleeding은 두 군간에 차이가 없었다(1.9% 대 3.0%). 현재 여러 단체에서 anticoagulation 치료지침안을 제시하고 있고, 관련된 임상연구도 계획 중이거나 진행중이다. 대략적인 anticoagulation의 맥락은 COVID-19 coagulopathy 발생 위험이 높은 경우에는 기존 용법에 비해 escalated-dose prophylaxis를 적극적으로 도입하는 것이다.3
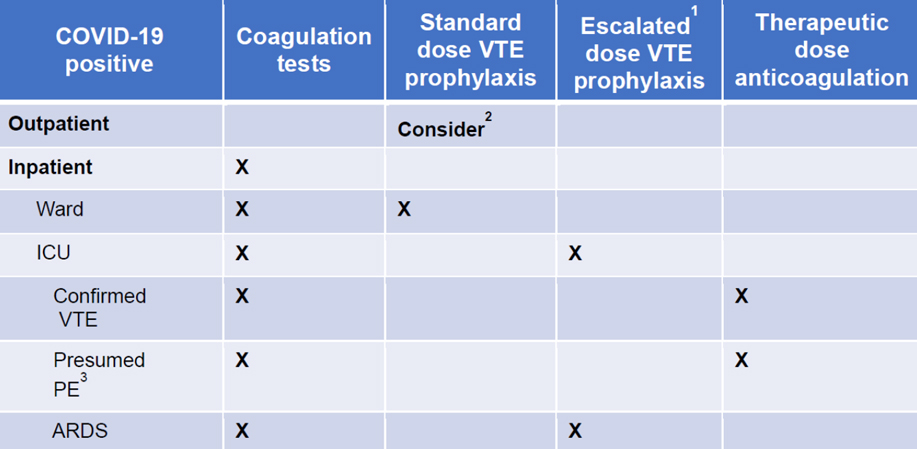
그림 4. COVID-19 감염증에서의 anticoagulation 지침9
Standard-dose prophylaxis: enoxaparin 40 mg QD
Escalated-dose prophylaxis: 0.5 mg/kg enoxaparin bid
Therapeutic-dose prophylaxis: 1 mg/kg enoxaparin bid
현재 흥미로운 사실은 전세계적으로 나라에 따라 COVID-19 치사율이 크게 차이가 난다는 것이다. 또한, 같은 나라에 거주하더라도 인종에 따른 치사율 차이도 중요한 이슈가 되고 있다. 특히, 흑인들은 다른 인종에 비해 2배 이상의 치사율을 보이고 있다. 이런 격차를 설명하기 위해, 사회-경제적 지위(socio-economic status), 문화적 배경 및 의료기관 접근성의 차이 등이 제시되고 있으나, 충분한 설명이 되지 못한다. 이전 연구를 보면, 미국 흑인들에서 높은 혈전 성향이 관찰되며, 심혈관계 질환(특히, 심부정맥 혈전증, 폐동맥 혈전증 및 심근경색)의 발생률이 높고 나쁜 예후를 보이고 있다. COVID-19가 “thrombosis-inflammation interaction”으로 설명된다면, 미국 흑인에서 관찰되는 높은 치사율도 ‘이들의 피가 다른 인종에 비해 끈적하다’는 것이 일부 원인이 될 수 있으나, 향후 보다 많은 임상적 근거가 쌓여야 할 것이다.
정리하자면, COVID-19 감염증은 전형적인 thrombo-inflammatory syndrome으로 생각되며, 적절한 antiviral treatment 뿐 아니라 anticoagulation treatment의 도입이 환자의 예후를 향상시키는 데에 도움이 되리라 생각된다. 아직 D-dimer 이외에는 적절한 coagulation test가 없어 이의 발굴 및 개발이 필요하며, 이를 바탕으로 한 적절한 anticoagulation 약제, potency 및 기간의 적용을 통해 COVID-19 coagulopathy 예방 및 치료가 향후 중요한 연구과제가 되겠다.
| 참고문헌 | |
| 1. | Barison A, Aimo A, Castiglione V, et al. Cardiovascular disease and COVID-19: les liaisons dangereuses. Eur J Prev Cardiol. 2020;2047487320924501. |
|---|---|
| 2. | Merad M, Martin JC. Pathological inflammation in patients with COVID-19: a key role for monocytes and macrophages. Nat Rev Immunol. 2020;20(6):355‐362. |
| 3. | Connors JM, Levy JH. COVID-19 and its implications for thrombosis and anticoagulation. Blood. 2020;135(23):2033‐2040. |
| 4. | Bikdeli B, Madhavan MV, Jimenez D, et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-up [published online ahead of print, 2020 Apr 15]. J Am Coll Cardiol. 2020;S0735-1097(20)35008-7. |
| 5. | Bikdeli B, Madhavan MV, Jimenez D, et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-up [published online ahead of print, 2020 Apr 15]. J Am Coll Cardiol. 2020;S0735-1097(20)35008-7. |
| 6. | Bikdeli B, Madhavan MV, Jimenez D, et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-up [published online ahead of print, 2020 Apr 15]. J Am Coll Cardiol. 2020;S0735-1097(20)35008-7. |
| 7. | Paranjpe I, Fuster V, Lala A, et al. Association of Treatment Dose Anticoagulation with In-Hospital Survival Among Hospitalized Patients with COVID-19 [published online ahead of print, 2020 May 5]. J Am Coll Cardiol. 2020;S0735-1097(20)35218-9. |